完全ヒト抗体の作製
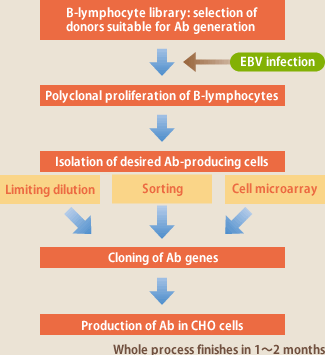
現在の抗体開発はマウスを用いるハイブリドーマ法、大腸菌を用いるファージディスプレイ法が主流であるが、これらの技術には活性の高い抗体が取れ難い、欧米の特許に対し多額のライセンス料を支払わなければならない、などの問題がある。株式会社イーベックではEBウイルス(EBV、大部分のヒトに持続的に感染しており、抗体産生細胞であるBリンパ球を無限増殖させる活性がある)を用いてヒト血液中のBリンパ球を増殖させ、そこから目的抗体産生リンパ球を分離することにより、ヒト体内でナチュラルな免疫過程を経て親和性成熟した高活性な抗体を作製する方法を開発した。EBVを用いる抗体作製法は30年以上前から知られた技術ではあるが、リンパ球の培養や目的抗体産生リンパ球の選別が難しく、成功例の報告は少ない。イーベックの技術の根幹は、EBV感染リンパ球の培養を初めとする多くのノウハウに加え、100人のドナーリンパ球からなる抗体ライブラリーの開発により目的抗体作製に適したドナーの選別が4日間でできるようにしたこと、目的抗体産生リンパ球の選別のために、従来の限界希釈培養法に加え、ソーティング法、セルマイクロアレイ法を開発したことにある(図1)。これにより、1つのターゲットにつき20種類の抗体を半年で作製することが可能となった。既に、顆粒球―マクロファージコロニー刺激因子(GM-CSF)、サイトメガロウイルスなどに対する高活性な抗体作製に成功している。
(図1)
抗体はその高い標的特異性から副作用が低く、効能が高い医薬品として期待され、既に上市された抗体医薬品には年間売上5000億円を超えるものも数品目あり、今後もさらなる成長が見込まれている(図2)。しかし、現状の抗体技術はそのほとんどが欧米の特許となっており、それらの使用には多額のライセンス料を支払う必要がある。また、それらの技術をもってしても作製できる抗体の活性はいまだ十分とはいえず、高額な薬価は医療保険財政の問題ともなっている。すなわち、我国独自の安価で高活性な抗体を作製できる技術が待望されている。本日は、株式会社イーベックが開発した血液リンパ球をソースとする抗体作製法についてお話しする。
(図2)
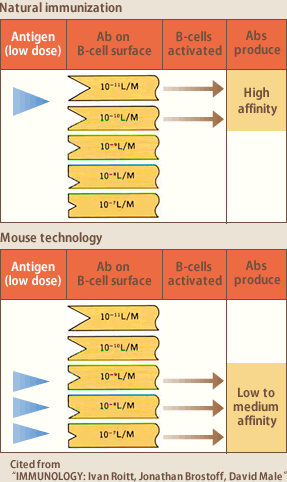
Bリンパ球は細胞表面に自身が産生する抗体を膜免疫グロブリンとして発現している。抗原がやってくると、数あるBリンパ球の中でその抗原に対する抗体を膜免疫グロブリンとして発現しているBリンパ球へ結合し、その結果Bリンパ球が活性化、増殖し、次いで形質細胞へ分化し抗体を産生する。例えば、インフルエンザウイルスに感染した場合は、インフルエンザ抗原に対する抗体を膜免疫グロブリンとして発現しているBリンパ球だけが活性化し、抗インフルエンザ抗体を大量に産生するわけである。抗原の濃度が低い時は、親和性の高い抗体を持つBリンパ球だけが抗原と反応して活性化され、抗原の濃度が高い時は、親和性の高低にかかわらずすべてのBリンパ球が活性化されるので、平均すると産生される抗体の親和性は低くなる(図3)。前者は、インフルエンザウイルス感染のような自然免疫の場合であり、後者が人工的にマウスを過剰抗原で短期間免疫するハイブリドーマ法の場合である。このことが、ハイブリドーマ法では親和性の高い抗体を得ることが難しく、逆に、ヒト血液リンパ球が高親和性抗体のソースとして優れていることの理論的裏付けである。我々の生体内では低濃度の抗原に繰り返し暴露されることにより高い親和性の抗体を産生するBリンパ球が選択的に増加する、いわゆる親和性成熟が常に起こっている。
(図3)
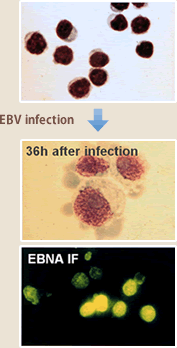
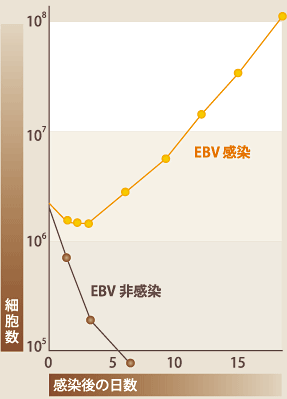
EBVはサイトメガロウイルスや水痘ウイルスと同じヘルペスウイルス科に属し、大部分のヒトは成人に達するまでにその洗礼を受ける。初感染は無症候性に終わることが多いが、思春期以降の感染では伝染性単核症というBリンパ増殖性の良性の病気を引き起こす場合がある。何れの場合も、ウイルスに対する免疫が確立されるが、ウイルスは免疫の標的となるウイルス抗原を発現しない潜伏感染により終生維持される。一般には終生無害な共存関係を維持すると考えられるが、エイズ、臓器移植後などの免疫不全状態ではEBV感染Bリンパ球の増殖症を引き起こし、それとは別にバーキットリンパ腫、上咽頭癌、T/NKリンパ腫などとの関連が明らかとなっており、ヒト癌ウイルスの一つである。発癌活性とも密接に関連したEBVの活性としてBリンパ球トランスフォーム活性がある。EBVはBリンパ球に特異的に発現しているCD21分子をレセプターとしてBリンパ球に効率良く感染し、増殖を誘導させる活性を有している(図4)。至適な条件ではほぼ100%のBリンパ球に増殖を誘導でき、感染した細胞は6ヶ月間以上は安定に増殖する。
(図4)
EBVによりヒトBリンパ球の増殖を誘導し、そこから特定の抗体を産生するリンパ球クローンを分離することはスウェーデンのSteinizらによって1977年に報告されている。本邦でも1980年代前半に日本大学の小野魁教授のグループが各種抗体の作製を報告している。当時の技術は、EBVを感染したBリンパ球をマイクロプレートに播種、培養し、3~4週間後に培養上清中に目的の抗体が存在するか否かを調べ、陽性ウェルの細胞(色々な抗体産生リンパ球のmixture)を再度新しいマイクロプレートに播種、培養し、この操作を繰り返すことにより目的抗体を産生する細胞クローンを分離するというものである(図5)。この方法の難しい点は、目的抗体を産生しているリンパ球の増殖速度が混在するリンパ球より遅い場合、培養を繰り返すことによりマイナーポピュレーションとなり消えてしまうことである。また、せっかく目的抗体産生クローンを分離しても、継代を続ける内に抗体の産生が悪くなったり、細胞の増殖が悪くなったり、あるいは得られる細胞の多くがIgM産生細胞であることもその後の抗体の取り扱いを難しくしている。また、当時は遺伝子組み換えの技術が普及しておらず、EBV感染リンパ球が産生する抗体を医薬品として使用することが考えられたが、癌ウイルスであるEBVの混入を100%排除することは困難であり、これも医薬品としての使用を不可能にした。
(図5)
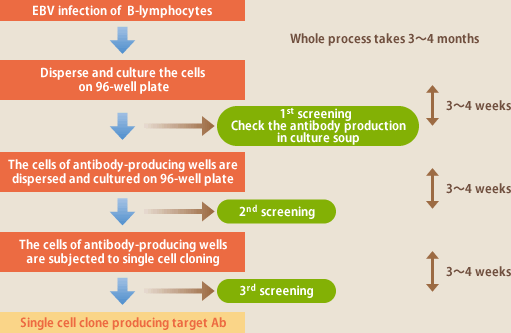
現在では、抗体産生細胞クローンが分離できれば、そこからRT-PCRにより抗体遺伝子をクローニングし、CHOなどの細胞で発現させることは容易であり、EBV感染リンパ球の増殖、抗体産生、EBV混入などの問題は完全に排除できるようになった。従って、目的の抗体産生リンパ球をいかに効率良く分離できるかがEBV法の課題であり、イーベックではその解決に向け技術開発を進めてきた(図1)。
![]()
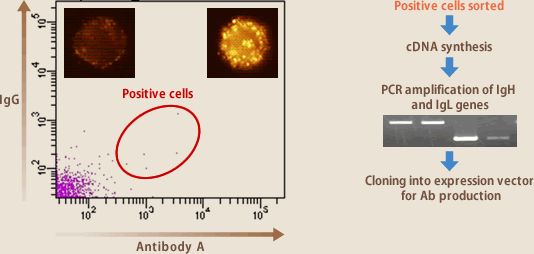
先に述べたように、Bリンパ球は自身が産生するBリンパ球を分泌型とは別に膜上に発現している。蛍光標識した抗原と反応させ目的抗体を産生するリンパ球をFACSにより分離することは可能である(図6)。また、抗原をコートしたマグネティックビーズを用いても同様のことが行える。ソーティング法の導入により、培養によるクローニング操作を行わなくても目的の抗体産生リンパ球を分離することが可能となり、抗体作製の高速化、効率化が達成された。ただ、この方法が有効なのは目的抗体産生リンパ球の割合が高い場合であり、低い場合には非特異的結合によるバックグラウンドにじゃまされて目的抗体産生リンパ球を分離することはできない。
(図6)
![]()
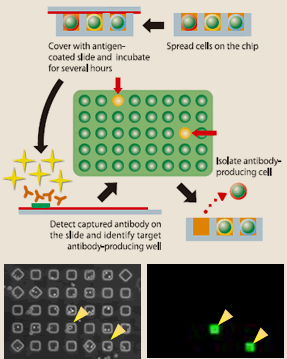
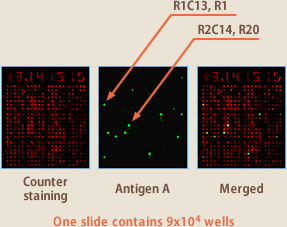
ソーティング法よりさらに魅力的なのはセルアレイ法である。9万ウェルあるマイクロチップの各ウェルにEBV感染リンパ球を落下させ、抗原をコートしたカバーグラスで覆い数時間培養する。カバーグラスを抗ヒト抗体で蛍光染色し、各ウェルで産生された抗体が抗原と反応するか否かをアレイスキャナーで判定する。抗原と反応する抗体を産生したウェルの細胞をマイクロマニピュレーターで分離し、RT-PCRにより抗体遺伝子を分離する(図7、8)。この方法も非特異的な反応があるので血液リンパ球からダイレクトに目的抗体産生リンパ球を分離するのは、急性感染症から回復直後のin vivoで強固に免疫増幅した場合を除き、困難である。しかし、ソーティング法よりは精度が高く、イーベックでは、ケースバイケースで両方法を使い分けて抗体産生リンパ球を分離している。
(図7)
(図8)
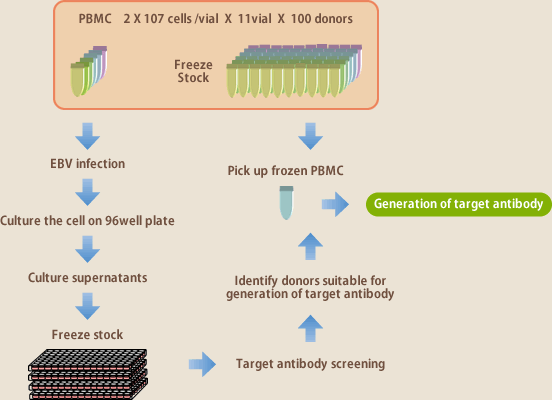
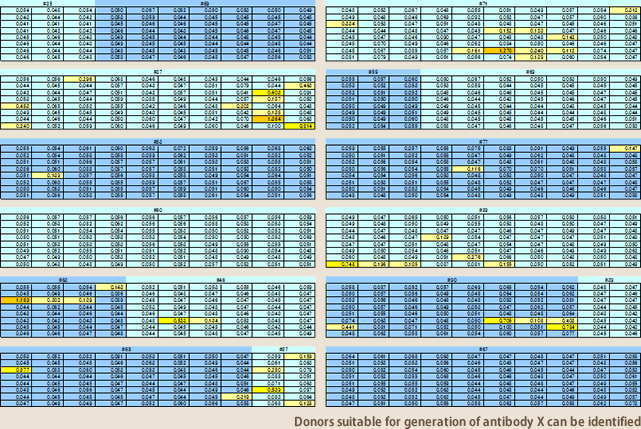
EBV法が標的とするのはメモリーBリンパ球である。例えば、感染症抗体の場合、その感染症を経験しているヒトをドナーとすることが必須条件となる。血清抗体価を測定すれば感染の有無はわかるが、血液中の抗体産生リンパ球の多寡は血清抗体価とは完全には相関しない。抗体産生リンパ球が得られるか否かは、実際の所、抗体作製を行ってみなければわからない。自己抗体の場合は、もっと難しく、ターゲットによっては100人のドナーを試みても1つも抗体がとれない場合もある。現状の抗体作製技術では、抗体の取得可能性を正確に予測することはできない。それを可能にするために、100人のドナーからなる抗体ライブラリーを開発した(図9)。1人のドナーにつき100~200mlの血液を採取し、そこから分離した単核球を11バイアルにわける。10個分は-152度で凍結保存、残る1バイアルはEBVを感染し、96ウェルプレートに播種、3~4週間培養後の上清を各ウェル別に集め凍結保存する。これが100ドナー分保存されている。あるターゲットの抗体を作製する場合、先ず、100人分の培養上清に目的抗体が存在するか否かをELISAで調べる。この作業は100人分が4日で終了する(図10)。これによりどのドナーが抗体作製に適しているかを知ることができる。次いで、抗体の存在が確認できたドナーだけを対象に凍結保存してある単核球から抗体作製を行う。抗体ライブラリーの導入により抗体作製スピードは従来の10倍以上になった。
(図9)
(図10)
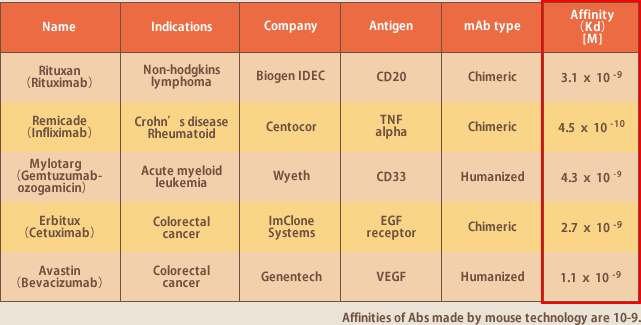
イーベックの抗体は完全ヒト抗体であり親和性が高い。従って、マウス抗体からヒト抗体へのヒト化、ファージディスプレイ法を用いての高活性化を必要とせず、そのまま医薬品抗体となり得る性能を有している。ヒト化、高活性化のための抗体技術にライセンス料を支払う必要が無いのも魅力である。ヒト血液リンパ球が生体内で親和性成熟を経ているために親和性が高いということは前述したが、実際にEBV法で多数の抗体を作製してみてそれが真実であることが実証された。上市されているマウスベースの抗体の親和性は10-9台であるが、我々が作製した抗体の半数は10-11台である。
抗体医薬は今後も右肩上がりの発展が期待されている。そういう中にあって、ヒト血液リンパ球は高活性抗体のソースとして魅力的であり、イーベックの抗体技術がマウス法と並ぶ主要な抗体技術として評価される日が来ることを確信している。





